En 2022, nous avons soumis trois articles parus dans des revues internationales à comité de lecture ainsi qu'un article dans une revue régionale à comité de lecture.
Publier dans de telles revues nous permet de transmettre connaissances et outils à la communauté scientifique ainsi qu'aux acteurs des écosystèmes que nous étudions, mais également de faire valider nos travaux de manière indépendante par des spécialistes du domaine. Ainsi, cette démarche permet de démontrer la fiabilité de nos travaux de recherche.
Les trois articles publiés dans des revues internationales sont tous associés à notre projet de recherche BIOME (BIOindication Mares et Etangs, financé par aquabio, une IPME biodiversité pilotée par l'ADEME, et la FDAAPPMA de Gironde), fruit de dix ans de travaux de recherche et de données récoltées sur plus de 300 plans d'eau de France continentale, visant à développer un indice pour les mares et étangs (plans d'eau peu profonds jusqu'à 50 ha): l'indice BECOME (Bioévaluation des ECOsystèmes Mares et Etangs).
Les deux articles dont nous discuterons ici ont été rédigés dans le cadre d'une thèse sous la direction de Christophe Piscart et Gabrielle Thiébaut (Université de Rennes 1 & CNRS). Ils proposent deux protocoles à utiliser pour suivre les macrophytes et les invertébrés des mares et étangs. Ces protocoles sont comparés à d'autres méthodes d'échantillonnage. Sont présentés également dans les articles quelques résultats permettant de mieux comprendre les facteurs environnementaux qui expliquent la distribution ou la structure des communautés. Nous allons discuter de l'efficacité de ces protocoles à la lumière de résultats obtenus sur le lac de Bourdouze en Auvergne (données non publiées). Ces deux articles sont disponibles sur demande sur la page researchgate du premier auteur.
La publication de ces articles s'inscrit dans une démarche finalement assez originale dans le domaine de la bioindication, car toutes les étapes font l'objet d'une validation indépendante par des pairs. Aucun autre indicateur ou protocole appliquable en France basé sur les macrophytes et les invertébrés des petits plans d'eau n'a fait l'objet d'une validation scientifique indépendante.
Le protocole invertébrés S3i, pour suivre les communautés d'invertébrés des mares et étangs.
Labat F., Piscart C. & Thiebaut G., 2022a. – Invertebrates in small shallow lakes and ponds: a new sampling method to study the influence of environmental factors on their communities. Aquatic Ecology, 56 doi : 10.1007/s10452-021-09939-1.
Le protocole invertébrés a été conçu pour obtenir l'image la plus représentative possible de la communauté en place en réalisant un minimum d'échantillons - et donc avec un coût minimal -. La résolution taxonomique (choix d'identifier certains groupes au genre ou à la famille), également déterminante pour le temps d'analyse, donc le coût du suivi, est issue de travaux déjà publiés en 2017 (Labat, 2017). Ainsi, contrairement au protocole associé à l'indice DCE IML (Dedieu & Verneaux, 2019, adapté aux plans d'eau DCE, généralement >50ha, mais certains plans d'eau des réseaux de suivi font moins de 50 ha et sont assimilables à des étangs), nous avons fait le choix de ne pas identifier les Chironomidae au genre. Toutefois, la richesse totale obtenue est très fortement corrélée à la richesse specifique tous groupes confondus, incluant les Chironomidae (Labat, 2017). Le temps d'analyse est ainsi de 1-3 jours pour BECOME, de 2-3 semaines pour l'IML, selon l'expérience des opérateurs, pour un temps d'échantillonnage comparable.
Les résultats de notre article de 2022 mettent notamment en évidence que la végétation littorale (<20cm de profondeur) est une zone d'accueil fondamentale pour la majorité des invertébrés. Ce résultat a des conséquences importantes dans le choix de la méthode à sélectionner pour évaluer un plan d'eau. Ainsi, le protocole IML exclut ces habitats littoraux, d'après une supposée variabilité de ces habitats. Cependant, les publications sur lesquelles reposent ce choix (Brodersen, 1995 ; Scheifhacken et al., 2007) n'ont analysé que la variabilité des habitats non végétalisés sur de très grands plans d'eau (avec un fort impact du vent). Ces habitats sont très pauvres donc statistiquement très variables, ce qui n'est pas le cas des habitats végétalisés, en particulier dans les petits plans d'eau. Par conséquent, appliquer le protocole DCE indice "IML" sur un plan d'eau peu profond de moins de 50 ha peut ne pas permettre d'obtenir une image représentative de la faune caractéristique de ces milieux, qui se réfugie principalement dans ces habitats rivulaires. Cela peut être problématique si on s'intéresse à l'intérêt patrimonial d'un plan d'eau peu profond (ce n'est pas l'objectif de l'IML), ou à certains impacts de pressions comme l'empoissonnement (non considérée par la DCE), cette pratique étant connue pour avoir un impact très important sur le fonctionnement de ces milieux (Moss et al., 1997 ; Scheffer, 2004 ) et sur les espèces les plus caractéristiques des mares et étangs (Labat, 2021 ; Nieoczym et al., 2023). Au contraire, exclure ces habitats et identifier les Chironomidae peut être une force pour évaluer l'impact d'autres pressions sur des grands plans d'eau : tous ces plans d'eau étant peuplés par des poissons, exclure une bonne partie des invertébrés nageurs sensibles à la prédation piscicole et s'intéresser plus en détail à un groupe qui l'est peu peut permettre de s'affranchir plus facilement de ce facteur.
Ainsi, si l'on compare les richesses taxonomiques observées avec trois protocoles (IML, S3i et ICOCAM, protocole utilisé pour évaluer l'état de conservation de certaines mares en France à partir des Coléoptères aquatiques (Picard, 2016)) sur le lac de Bourdouze, plans d'eau peu profond de 19 ha, on observe que la faune caractéristique des milieux stagnants (Coleoptera, Heteroptera et Odonata) est moins riche avec l'IML (Figure 1). Celui-ci est plus performant pour les Trichoptères : c'est lié à la différence de période d'échantillonnage, début du printemps pour l'IML, été pour S3i, la majorité des Trichoptères en plans d'eau émergeant en général au printemps. La richesse en Chironomidae d'après l'IML est de 18 taxons, ce qui correspond à 26% de la richesse totale. L'indice ICOCAM, en ne considérant que les Coléoptères aquatiques (ici, nous n'avons capturé qu'une seule espèce par genre) est très peu informatif sur un plan d'eau de grande taille comme Bourdouze (10% de la richesse totale). Nous avons donc trois protocoles aux objectifs très différents, adaptés à des milieux bien spécifiques, avec des indicateurs associés qui ne sont probablement pas sensibles de la même manière aux pressions. L'indice ICOCAM, qui ne s'intéresse qu'aux Coléoptères, est probablement plus sensible à la présence de poissons, et moins sensibles aux autres pressions (faute de publication sur l'ICOCAM, il n'est pas possible de s'assurer de la relation entre pressions et indice). L'indice BECOME (protocole S3i) est sensible à une très large gamme de pressions (Labat & Usseglio-Polatera, in prep.), mais n'est pas conçu pour évaluer l'effet du marnage des grandes retenues comme l'IML.
Il convient donc de bien choisir le protocole le plus adapté au milieu et aux questions posées.
Figure 1 : comparaison des richesses taxonomiques par grands groupes d'invertébrés obtenus avec les protocoles IML et S3i. Les résultats ICOCAM ont été déduits de la liste complète issue des deux protocoles. Les niveaux taxonomiques ont été harmonisés pour faciliter la comparaison
Le protocole macrophytes S3m, pour suivre les communautés de macrophytes des mares et étangs.
Dans cet article, nous démontrons la flexibilité du protocole S3m, que nous avons pu appliquer sur des plans d'eau de 1m² à 42 ha. Nous obtenons des résultats globalement équivalents à des méthodes par quadrat ou par cartographie, avec toutefois des temps d'échantillonnage beaucoup plus courts, et une meilleure capacité à détecter les espèces rares ou exotiques que les méthodes par transects ou quadrats. Il s'agit donc d'un protocole rapide plus adapté à la gestion conservatoire que les protocoles IBML et IBEM par exemple. Ainsi, si nous comparons les résultats obtenus sur le lac de Bourdouze avec le protocole S3m et IBML (Figure 2), le protocole S3m permet d'obtenir une richesse taxonomique et un nombre d'espèces protégées au niveau national plus élevés qu'avec le protocole IBML, avec un temps sensiblement inférieur pour le protocole S3m (sur des plans d'eau de beaucoup plus grande taille, le temps de relevé du protocole IBML serait bien évidemment plus court!). Là encore, nous avons deux protocoles aux objectifs bien différents : l'objectif du protocole IBML est d'obtenir un état "trophique", il convient juste de relever suffisamment de taxons avec un profil écologique pour calculer un IBML, ce qui est assez "facile" à obtenir sur des grands plans d'eau, naturellement plus riches en espèce. L'objectif du protocole S3m est d'évaluer un état de conservation et un état écologique (dont trophique) face à un plus large panel de pressions (indice BECOME, volet macrophytes), et d'évaluer l'efficacité des mesures de gestion sur l'intérêt conservatoire ou le fonctionnement du plan d'eau. La pression d'échantillonnage est adaptée pour récolter un maximum d'information (en un minimum de temps), ce qui est fondamental pour des petits plans d'eau, naturellement plus pauvres en espèces (Labat et al., 2021). Il convient donc là encore de sélectionner le protocole d'échantillonnage le plus adapté pour répondre aux questions posées.
Rédigé par Frédéric Labat le 06/01/2023
Les bureaux d'étude en hydrobiologie identifient les invertébrés aquatiques au genre ou à la famille, afin de calculer des indices biologiques. Depuis les débuts d’Aquabio, nous avons cherché à identifier à l'espèce tous les groupes d’invertébrés aquatiques. Cette expertise nous permet d'améliorer les connaissances sur la biodiversité et mieux répondre à certaines études d'impact ou d'évaluation de mesures de gestion.
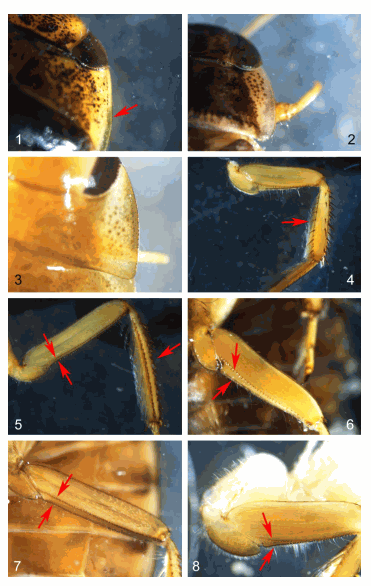
Nouveaux critères d'identification de Naucoris maculatus et Ilyocoris cimicoides. Extrait de Labat, 2017. Photographies F. Labat.
Réaliser des analyses hydrobiologiques à des niveaux taxonomiques standardisés (principalement au genre ou à la famille) requiert des compétences taxonomiques importantes. Chez Aquabio, une formation des nouveaux arrivants sur une centaine d’analyses est ainsi généralement nécessaire pour assurer des identifications de qualité. Ces niveaux standardisés permettent de calculer les indicateurs nationaux ou de travailler sur des approches fonctionnelles, mais répondent parfois mal à certaines problématiques, notamment patrimoniales ou hydromorphologiques (LABAT et al. in prep.).
Depuis les débuts d’Aquabio, nous nous sommes engagés dans l’acquisition de compétences taxonomiques sur tous les groupes d’invertébrés aquatiques, y compris leurs imagos terrestres.
Depuis 2016, nous pouvons identifier tous les groupes d’invertébrés aussi précisément que la littérature le permet, y compris des groupes très peu étudiés comme les Hydracariens ou les Diptères (probablement les 2 groupes les plus diversifiés dans les écosystèmes aquatiques, et qui peuvent apporter un grand nombre d’informations sur le fonctionnement de ces écosystèmes).
Aquabio contribue ainsi à la connaissance de groupes faunistiques souvent peu étudiés. De nombreux inventaires bénévoles ou études reposant sur ces compétences ont à ce jour fait l’objet de publications dans des revues scientifiques nationales ou internationales.
Notre premier article signalait la redécouverte en France de l’Ephéméroptère Neoephemera maxima Joly, présent uniquement sur la Leyre (FONTAN et al, 1999). Depuis, 15 autres articles ont paru, dont 4 en 2019 : (1) sur les invertébrés aquatiques de Hong Kong (LABAT 2019a) , (2) sur les Hétéroptères aquatiques d’Aragon avec l’association ZICRONA (ELDER et al., 2019), (3) un inventaire des coléoptères aquatiques de la rivière Dordogne accompagnée d’une analyse de la répartition nationale et des exigences écologiques de quelques espèces (LABAT, 2019a), et enfin (4) grâce à notre méthode d’évaluation des plans d’eau BECOME, dix nouvelles localités d’un Trichoptère rarissime, Tricholeiochiton fagesii Guinard, avec nos collègues de l’ENGEES et du LIEC (LABAT et al., 2019).
- Elder J.-F., Tanco J., Philippe Loncle, Moulet P. & Labat F., 2019. – Contribution à la connaissance des hétéroptères aquatiques et semi-aquatiques de la Communauté autonome d’Aragon, Espagne (Insecta, Heteroptera, Gerromorpha et Nepomorpha). Boletín de la Sociedad Entomológica Aragonesa, 65 : 296‑300.
Fontan B., Brulin M. & Masselot G., 1999. – Redécouverte de Neopephemera maxima (Joly, 1870) pour la France [Ephemeroptera : Neoephemeridae]. Ephemera, 1 (1) : 31‑34.
- Labat F., 2019a. – Note sur les invertébrés aquatiques récoltés dans 4 cours d’eau de Hong Kong. Arvernsis, 87‑88 : 3‑31.
- –––., 2019b. – Le macrobenthos du bassin de la Dordogne. 5ème note : la rivière Dordogne, répartition des Coléoptères aquatiques [Coleoptera] - précisions sur la répartition nationale de quelques espèces. Bulletin de la Société Linnéenne de Bordeaux, 154 (3/4) : 299‑313.
- Labat F., Auzeric E., Courte M., Fernandez N., Gaillard D., Grac C., Lambert J., Meyer A., Moreau A., Poujardieu B. & Tarozzi N., 2019. – Nouvelles localités de Tricholeiochiton fagesii (Guinard, 1879) en France [Trichoptera, Hydroptilidae]. Ephemera, 20 (2) : 107‑112.
Labat F., Gréaume C., Santos L. & Zeiller R., in prep. – Dam impact in a sandy river : limits of standardized methods and interest of Chironomid communities.
- Labat F., 2017. – Note sur l’identification rapide des individus immatures et matures de Naucoris maculatus Fabricius, 1798 et d’Ilyocoris cimicoides (Linnaeus, 1758) (Hemiptera, Naucoridae). Bulletin de la Société Linnéenne de Bordeaux, 45 (4) : 440‑442.
Les 16 publications parues sont disponibles sur demande : contact@aquabio-conseil.com.
Identifier rapidement et à faible coût les espèces présentes dans un simple échantillon d’eau ou de sédiment en se passant de loupe ou microscope : telle est la promesse de l’ADN environnemental (ADNe), dont les développements récents annoncent une révolution dans le domaine de l’hydrobiologie. Le metabarcoding génétique a notamment supplanté les analyses morphologiques de diatomées en Angleterre depuis 2018 et y sera aussi utilisé pour la caractérisation de l’ichtyofaune des plans d’eau.
Les promesses de l’ADNe sont nombreuses : meilleure réactivité, faible coût, identification taxonomique plus précise et non invasive, plus grande intégration spatiale et temporelle. Ces méthodes pourraient permettre de mieux détecter des espèces rares ou invasives, d’analyser des milieux ou des organismes échappant à la méthode morphologique ou d’élaborer des indicateurs de fonctions métaboliques ou écologiques.
Cependant l’ADNe souffre de certains biais qui freinent son émergence : contaminations, faux positifs, hétérogénéité entre les méthodes des différents laboratoires et absence de maîtrise des limites de détection et de la reproductibilité.
D’autres facteurs tels que le manque de connaissance sur le devenir de l’ADN dans l’eau ou sur les facteurs de contrôles biologiques et environnementaux, l’absence de donnée d’abondance ou de biomasse et les lacunes des banque de donnée génétiques sont également des freins à l’implémentation de l’ADNe. Il résulte que les différents acteurs de la qualité de l’eau ont encore besoin de gagner en expertise sur cette technologie aux changements fréquents et rapides pour permettre son intégration dans la législation.
Au travers de partenariats avec l’INRAE, Spygen ou ID Gene, Aquabio participe à l’émergence des analyses hydrobiologiques de demain. Nous sommes convaincus que l’expertise taxonomique est indissociable de la biologie moléculaire et de la bio-informatique pour réunir ADNe et bioindication de qualité. Nous nous sommes engagés dès 2016 au côté des organismes de recherche, administrations et gestionnaires :
2016 -2017 : Projet AFB/INRA Bioindication diatomées : comparaison microscopie / barcoding ADN.
2017 - 2020 : Réseau européen DNAqua-Net sur la mise en œuvre de méthodes de bioindication génétique dans la Directive Cadre sur l'Eau (DCE).
2017 : Séminaire AFB sur l’ADN environnemental.
2019 : Programme SYNAQUA - Séminaire de réflexion sur le déploiement des outils ADN pour la bio-indication.
2019 : AFNOR - journée technique "Les outils ADNe appliqués à la surveillance de l’état et de la biodiversité des milieux aquatiques".
2020 : Formation métabarcoding des diatomées avec l’INRAe. Ateliers DNAqua-Net/ECOSTAT pour l’implémentation de l’ADNe.
- 2021 : Projet NanoDiat en partenariat avec l’INRAe pour mettre au point une nouvelle génération technologique du barcoding des diatomées.
Aquabio est également impliqué dans la normalisation de l’ADNe en tant qu’expert technique du working group 28 sur l’ADNe au sein du Comité Européen de Normalisation et en tant que membre du la commission AFNOR T95F.
Notre investissement se poursuit avec le projet NanoDiat de 2021 à 2023. Ce projet porté par Aquabio, en partenariat avec l'INRAe, vise à développer une identification des diatomées basée sur le métabarcoding au moyen d’une nouvelle génération de séquenceurs d’ADN.
Pour en savoir plus :
Remy Marcel - Référent NanoDiat, membre du CEN TC230 WG28 et du réseau DNAqua-Net : remy.marcel@aquabio-conseil.com.
Article dressant un bilan par élément biologique et type de masse d'eau de l'applicabilité des méthodes ADN pour les suivis DCE : Hering D, Borja A, Jones JI, Pont D, Boets P, Bouchez A, Bruce K, Drakare S, Hänfling B, Kahlert M, Leese F, Meissner K, Mergen P, Reyjol Y, Segurado P, Vogler A, Kelly M (2018) Implementation options for DNA-based identification into ecological status assessment under the European Water Framework Directive. Water Research 138: 192‑205.
Une exigence de la Directive Cadre Européenne
Une directive cadre européenne de 2008 (modifiée en 2013) établit des normes de qualité environnementale (NQE) pour la surveillance des polluants prioritaires dans les milieux aquatiques. Il s’agit de rechercher les polluants bioaccumulés dans les organismes aquatiques (poissons et invertébrés).
Deux approches peuvent être utilisées :
-
les approches passives s'appuient sur le prélèvement ou la collecte d’organismes autochtones sur la station de mesure. Elle permettent de vérifier la conformité des biotes prélevés vis-à-vis de NQE (Normes de Qualité Environnementales) applicables dans cette matrice et d’évaluer un risque envers les prédateurs supérieurs et/ou l’Homme par l’ingestion de proies/produits de la pêche contaminés
-
les approches actives reposent sur la transplantation, par encagement, d’organismes provenant d’une population source de référence. Elles permettent d’améliorer la comparabilité des résultats et de fiabiliser leur interprétation en termes de tendances.
La France a décidé de suivre les deux approches : collecte de chair de poisson pour l’approche passive, et encagement de gammares pour l’approche active.
Une méthode issue de la recherche
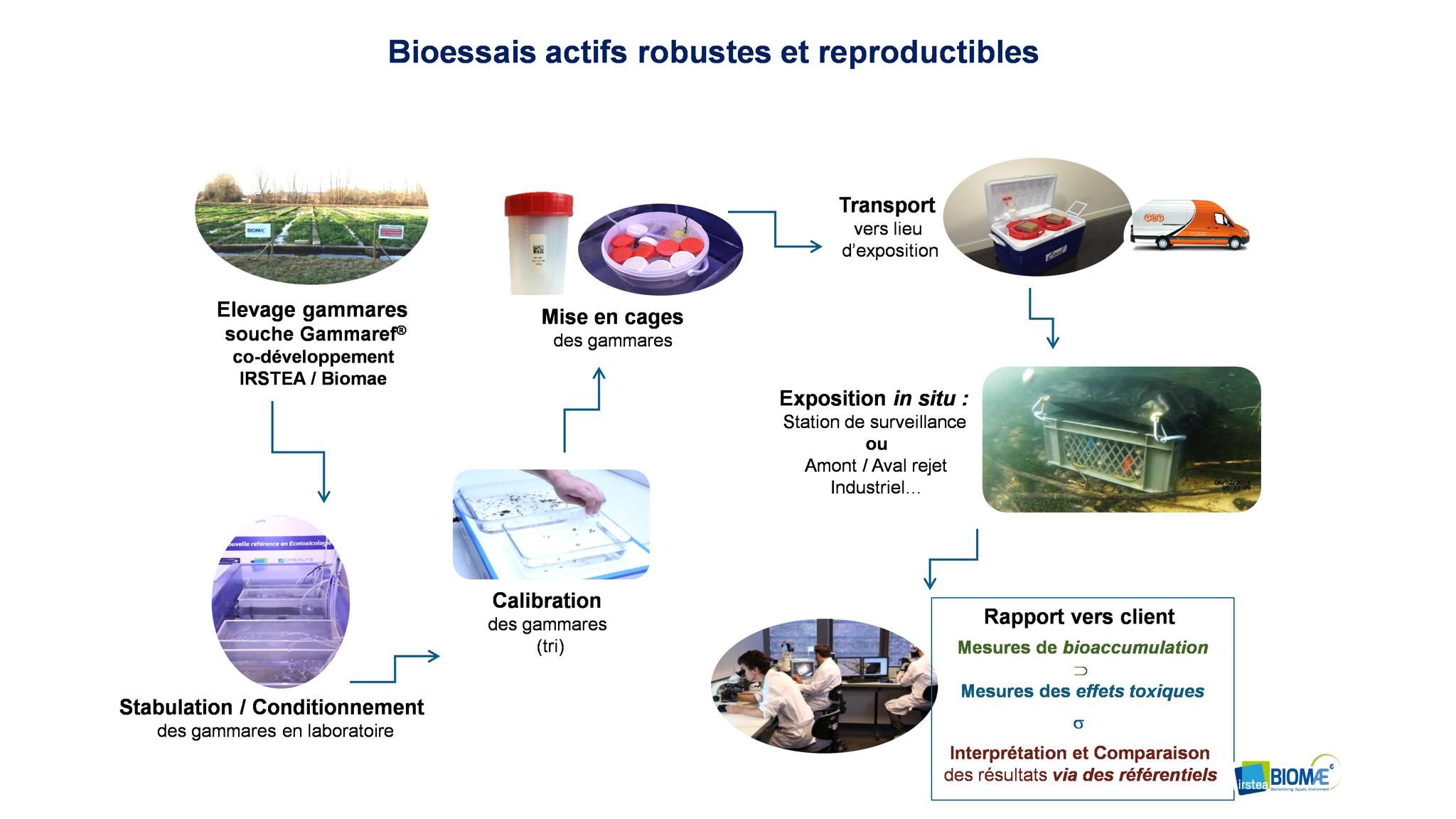
La méthode d’encagement de gammares est issue de 10 années de recherche d’IRSTEA. Elle est développée par la société BIOMAE (Spinoff du laboratoire d’écotoxicologie d’IRSTEA), et a fait l’objet de tests à grande échelle en partenariat avec Aquabio qui a pu apporter son expérience de terrain. La méthode, en cours de normalisation, prévoit plusieurs étapes :
Figure 1 : Du prélèvement des gammares jusqu’à l’exposition in situ dans les cours d’eau (Biomae)
-
Prélèvement de gammares dans une station de référence ou une population source : BIOMAE possède une ancienne cressonnière dans laquelle il assure l’élevage d’une population homogène. Deux espèces peuvent être utilisées : Gammarus pulex et Gammarus fossarum.
-
Stabulation et calibration en laboratoire. Les organismes sont maintenus pendant 7 jours dans des conditions contrôlées pour la température, la conductivité, l’oxygène, l’alimentation et photopériode. Puis une sélection des individus est opéré pour obtenir des mâles d’une taille et d’un poids homogène.
-
Encagement pendant 21 jours dans le milieu. Les individus calibrés sont introduits dans des cages ajourées permettant les échanges avec le milieu, puis acheminés sur la station de mesure dans des conditions ambiantes contrôlées (température, oxygène dissous). Ils sont déposés dans une zone profonde et lotique, pendant 21 jours.
A la fin de la durée d’exposition, ils sont réacheminés vers le laboratoire en les maintenant dans l’eau issue de la rivière. -
Conditionnement avant analyses. Au laboratoire, les individus morts ou moribonds sont comptabilisés et retirés. Les gammares survivants sont congelés et envoyés au laboratoire d’analyse pour recherche des contaminants métalliques et organiques.
Les concentrations biodisponibles brutes des 250 molécules obtenues peuvent ensuite être interprétées en fonction du niveau de contamination par rapport à un référentiel Irstea / Biomae construit au niveau français ou du niveau de contamination par rapport aux NQE fixées par l’Union Européenne.
Une méthode aux applications multiples
Le même bioessai peut également être utilisé, au-delà de la DCE, pour évaluer la biotoxicité dans le cadre de suivi en milieu naturel : amont-aval rejet industriel , amont-aval déversoir d’orages, avant-après une interaction sur le milieu naturel (lâcher de barrage, travaux, etc.).
D'autres bioessais sont également pratiqués par Biomae pour évaluer le niveau de toxicité de l’ensemble des micropolluants présents dans le milieu récepteur par implémentation (alimentation, neurotoxicité, reprotoxicité et perturbation endocrine).
Conseil d'expert
La bioaccumulation est l'absorption de substances chimiques, présentes dans l'environnement, et leur concentration dans certains tissus par les organismes. La biodisponibilité désigne la fraction d'une substance ayant la possibilité d'être absorbée et d'être utilisée par le métabolisme d'un organisme vivant.
Pour aller plus loin...
- Téléchargez la Note technique du 26 décembre 2017 relative à la mise en œuvre du suivi des substances de l’état chimique des eaux de surface dans le biote dans le cadre de la directive cadre sur l’eau conformément à la directive 2013/39/UE du Parlement européen et du Conseil du 12 août 2013
- Site internet BIOMAE
Contacts
Laurent Viviani (Co-fondateur Biomae) - laurent.viviani@biomae.fr
Bruno Fontan (Directeur Technique d'Aquabio et membre commission AFNOR T95E Biosurveillance de l'environnement ) - bruno.fontan@aquabio-conseil.com
PARTAGEZ